Η ΘΕΡΑΠΕΙΑ ΜΑΣ
ΠΩΣ ΑΝΤΙΜΕΤΩΠΙΖΟΥΜΕ ΤΗΝ ΗΛΙΚΙΑΚΗ ΕΚΦΥΛΙΣΗ ΩΧΡΑΣ ΚΗΛΙΔΑΣ;
Η ηλικιακή εκφύλιση ωχράς κηλίδας χρήζει διαφορετικής αντιμετώπισης ανάλογα με τον τύπο της και για τον λόγο αυτό η διενέργεια ειδικών εξετάσεων όπως της O.C.T τομογραφίας και την O.C.T. αγγειογραφίας που προαναφέρθηκαν είναι αναγκαίες προς ταυτοποίηση του τύπου της ωχροπάθειας.
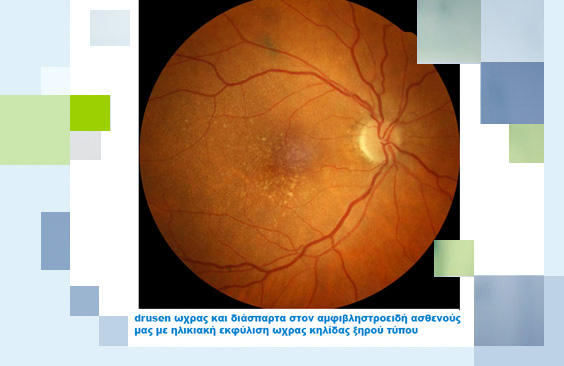
Η ηλικιακή εκφύλιση ωχράς ξηρού τύπου, όπως αναφέρθηκε αποτελεί νόσο με ιδιαίτερα αργή εξέλιξη που συνήθως απαιτεί αρκετά χρόνια εώς ότου προκαλέσει έκπτωση της οπτικής οξύτητας του ασθενούς. Ωστόσο, δεν διαθέτει κάποια αποτελεσματική και ειδική θεραπεία ικανή να αναστρέψει τις προκληθείσες βλάβες, αλλά, η θεραπεία της εστιάζει στην παρακολούθηση και την επιβράδυνση της εξέλιξης της νόσου. Η τακτική παρακολούθηση με O.C.T. τομογραφία έχει ως στόχο τον έγκαιρο εντοπισμό πιθανής μετάπτωσης της ωχροπάθειας ξηρού τύπου σε υγρού, ενώ προς αποτροπή του ενδεχομένου αυτού χορηγούνται ειδικά συμπληρώματα διατροφής τα οποία πέραν αυτής τους της δράσης, σύμφωνα με έρευνες, μπορούν να καθυστερήσουν και την εξέλιξη της νόσου. Παράλληλα η αποφυγή των παραγόντων κινδύνου (έκθεση στην ηλιακή ακτινοβολία, κάπνισμα, παχυσαρκία, δίαιτα πτωχή σε πράσινα λαχανικά, υπέρταση) κρίνεται απαραίτητη προς επιβράδυνση της εξέλιξης της νόσου.
Σε περίπτωση μετάπτωσης της νόσου σε ωχροπάθεια υγρού τύπου η εξέλιξη της είναι ταχεία και χρήζει άμεσης αντιμετώπισης, καθώς σε αυτόν τον τύπο υπάρχει ειδική και αποτελεσματική θεραπεία η οποία συνίσταται σε ενδοϋαλοειδικές ενέσεις anti-VEGF: πρόκειται για ενέσεις οι οποίες πραγματοποιούνται εντός του οφθαλμικού βολβού στον οποίο διαχέουμε anti-VEGF (anti-VEGF = αντί- Αγγειακός Ενδοθηλιακός Αυξητικός Παράγοντας). Ο VEGF πυροδοτεί τη μη φυσιολογική διαρροή και ανάπτυξη αιμοφόρων αγγείων στην ωχρά κηλίδα, η οποία θα οδηγήσει στην ανάπτυξη του οιδήματος. Πρόκειται για μία καινοτόμο θεραπεία η οποία εφαρμοζόμενη την τελευταία δεκαετία αποτελεί πλέον τη βάση της αντιμετώπισης όλων των παθήσεων του βυθού που σχετίζονται με την ανάπτυξη νεοαγγείωσης. Ο dr. Ιωάννης Αιμ. Ζησούλης διαθέτει πολύ μεγάλη εμπειρία στην τέλεση ενδοϋαλοειδικών ενέσεων anti-VEGF αποτελώντας έναν από τους πρώτους ιατρούς στην Ελλάδα που εφάρμοσαν μαζικά την τεχνική, έχοντας πραγματοποιήσει εκατοντάδες ενέσεις. Στο ιατρείο μας ακολουθούνται όλες οι σύγχρονες τεχνικές εκτίμησης (Ο.C.T. τομογράφος Angiovue της Optovue με αγγειογραφία) και παρακολούθησης της εξέλιξης του βυθού των ασθενών στους οποίους χορηγούνται ενδοϋαλοειδικές ενέσεις anti-VEGF, προκειμένου να γίνεται η καλύτερη επιλογή του αριθμού και του χρόνου πραγματοποίησης των αναγκαίων ενέσεων.
Ο dr.Ιωάννης Αιμ. Ζησούλης πραγματοποιεί αποκλειστικά τις διεθνώς εγκεκριμένες ενδοϋαλοειδικές ενέσεις ranibizumab (Lucentis) και aflibercept (Eylea) σε αντίθεση με μεγάλο αριθμό ιδιωτών αλλά και δημοσίων νοσοκομείων που χρησιμοποιούν μη εγκεκριμένες ενέσεις bevacizumab (Avastin).Οι εγκεκριμένες ενδοϋαλοειδικές ενέσεις ranibizumab και aflibercept διαθέτουν υψηλή αποτελεσματικότητα στην καταστολή της χοριοειδικής νεαγγείωσης της ηλικακής εκφύλισης ωχράς υγρού τύπου, ενώ παράλληλα δεν ενέχουν κινδύνους για την αγγείωση άλλων συστημάτων του ασθενούς καθώς σύμφωνα με έρευνες διαθέτουν φαρμακοτεχνική δομή που δεν επιτρέπει την έξοδο τους από τον οφθαλμό προς άλλα συστήματα. Αντιθέτως, οι μη εγκεκριμένες ενέσεις bevacizumab έχει αποδειχθεί ότι πέραν των ενδοϋαλοειδικών τους συγκεντρώσεων επιτυγχάνουν συγκεντρώσεις και σε άλλα συστήματα του ασθενούς καταστέλλοντας την νεοαγγείωση όχι μόνο στον χοριοειδή χιτώνα του οφθαλμού (επιθυμητό αποτέλεσμα) αλλά και σε όργανα όπως η καρδία, όπου η νεοαγγείωση είναι απαραίτητη σε έναν ασθενή ο οποίος πάσχει από στεφανιαία νόσο και εμφανίζει υψηλό κίνδυνο ή έχει ήδη υποστεί ισχαιμικό επεισόδιο (μη επιθυμητό – δυνητικά επικίνδυνο αποτέλεσμα). Με το πέρας κάθε ενδοϋαλοειδικής ένεσης χορηγείται στον ασθενή βεβαίωση του ιατρού και της κλινικής με τα παραστατικά της συσκευασίας και το serial number της γνήσιας ένεσης που χρησιμοποιήθηκε.

ΓΙΑΤΙ ΧΡΗΣΙΜΟΠΟΙΟΥΜΕ ΑΠΟΚΛΕΙΣΤΙΚΑ ΤΙΣ ΕΓΚΕΚΡΙΜΕΝΕΣ ΕΝΕΣΕΙΣ KAI OXI AVASTIN?

Η μπεβασιζουμάμπη (Avastin) είναι αντιαγγειογενετικός παράγοντας, που όμως έχει αναπτυχθεί για ενδοφλέβια χορήγηση στην αντιμετώπιση διαφόρων μορφών καρκίνου. Η ουσία αυτή δεν έχει αναπτυχθεί για να ενίεται μέσα στο μάτι. Ως εκ τούτου, δεν επιτρέπεται να χορηγείται με αυτόν τον τρόπο. Ο λόγος που οι οφθαλμίατροι επιλέγουν το Avastin για τη θεραπεία της ηλικιακής εκφύλισης της ωχράς κηλίδας είναι το κόστος, αφού πρόκειται για φθηνό φάρμακο. Και συχνά αυτό γίνεται εν αγνοία του ασθενή, ο οποίος πολλές φορές δεν γνωρίζει αν κάνει θεραπεία με τα εγκεκριμένα Lucentis και Eylea ή με το μη εγκεκριμένο avastin. Υπάρχουν και περιπτώσεις που χρησιμοποιείται avastin εν γνώση του ασθενή, χωρίς όμως να έχει ενημερωθεί για τις παρενέργειες που μπορεί να προκαλέσει η χρήσης του Avastin. Σε δημοσιευμένες μελέτες (CATT, IVAN κλπ) διαπιστώθηκε ότι η μη αδειοδοτημένη ενδοφθάλμια χρήση του Avastin έχει χαμηλότερη μακροχρόνια αποτελεσματικότητα , αλλά και σημαντικό κίνδυνο συστηματικών επιπλοκών όπως το αγγειακό εγκεφαλικό επεισόδιο.
Η Πανελλήνια Ένωση Αμφιβληστροειδοπαθών (ΠΕΑ) σε σχετικό δελτίο τύπου της, έχει αναφερθεί στο ζήτημα, ενστερνιζόμενη την επίσημη τοποθέτηση της AMD Alliance International, του διεθνούς οργανισμού εκπροσώπησης των ασθενών με ηλικιακή εκφύλιση ωχράς κηλίδας, επισημαίνοντας ότι «οι μελέτες εγείρουν σοβαρές ανησυχίες για τη συχνότητα εμφάνισης σοβαρών ανεπιθύμητων ενεργειών με το μη εγκεκριμένο φάρμακο Avastin (μπεβασιζουμάμπη) . Οι μελέτες δείχνουν αύξηση της εμφάνισης σοβαρών ανεπιθύμητων ενεργειών (π.χ. εγκεφαλικά επεισόδια αλλά και θάνατοι) με τη χρήση της πειραματικής θεραπείας στον οφθαλμό». Ενδεικτικό είναι ότι ο ίδιος ο Ευρωπαϊκός Οργανισμός Φαρμάκων τροποποίησε την περίληψη χαρακτηριστικών του προϊόντος Avastin, διευκρινίζοντας τα κάτωθι: Στην παράγραφο την σχετική με «Ειδικές προειδοποιήσεις και προφυλάξεις κατά τη χρήση», αναφέρεται ότι «η σύνθεση του Avastin δεν ενδείκνυται για ενδοϋαλοειδική χρήση». Επιπλέον στο φύλλο οδηγιών χρήσης, πληροφορίες για τον χρήστη ξεκαθαρίζεται ότι : «…Το Avastin έχει αναπτυχθεί και παρασκευαστεί για τη θεραπεία του καρκίνου με ένεση στην κυκλοφορία του αίματος. Δεν έχει αναπτυχθεί ή παρασκευαστεί για να ενίεται μέσα στο μάτι. Ως εκ τούτου, δεν επιτρέπεται να χορηγείται με αυτόν τον τρόπο.»
Υπάρχουν διεθνώς αυξανόμενα αποδεικτικά στοιχεία σύμφωνα με τα οποία η μη αδειοδοτημένη ενδοφθάλμια χρήση Avastin εκθέτει τους ασθενείς σε συστηματικούς (αγγειακό εγκεφαλικό επεισόδιο) και οφθαλμικούς κινδύνους ασφάλειας (όπως φλεγμονή ή επιπλοκές που είναι δυνατόν να προκαλέσουν σοβαρή διαταραχή της όρασης ή τύφλωση). Μάλιστα, τα δεδομένα από τη ανεξάρτητη μελέτη CATT (δύο ετών), την συγκεντρωτική CATT (ενός έτους) και την IVAN (ενός έτους) έδειξαν αυξημένο κίνδυνο εκδήλωσης σοβαρού ανεπιθύμητου συμβάντος με την μη αδειοδοτημένη ενδοφθάλμια χρήση του Avastin σε σύγκριση με το Lucentis, προσθέτοντας στο αυξανόμενο σώμα αποδεικτικών στοιχείων που υποδηλώνουν προβλήματα ασφάλειας σε σχέση με την μη αδειοδοτημένη ενδοϋαλώδη χρήση του Avastin. Ένα σημαντικό εύρημα είναι ότι η χορήγηση του Avastin στο εσωτερικό του οφθαλμού έχει ως αποτέλεσμα σημαντική μείωση των επιπέδων του αγγειακού ενδοθηλιακού αυξητικού παράγοντα (VEGF) που κυκλοφορεί στο αίμα, σε σύγκριση με το Lucentis. Αυτή η μείωση των επιπέδων του VEGF της κυκλοφορίας ενδέχεται να συνδέεται με αυξημένο κίνδυνο σοβαρών συστηματικών ανεπιθύμητων συμβάντων. Η δε Γαλλική μελέτη GEFAL, όταν συνδυάστηκε σε μετα-ανάλυση ασφάλειας με τις IVAN, CATT και MANTA, έδειξε σημαντικά περισσότερα σοβαρά συστηματικά ανεπιθύμητα συμβάντα με την μη αδειοδοτημένη ενδοϋαλώδη χρήση του Avastin σε σύγκριση με το Lucentis εντός ενός έτους (αναλογία πιθανοτήτων 1.34, όριο αξιοπιστίας 95%, 1.08 έως 1.65). Ακόμα όμως και στη διαδικασία παρασκευής τους, τα δυο αυτά διαφέρουν. Το Lucentis παράγεται με βάση τα υψηλότερα πρότυπα για ενδοφθάλμια (ενδοϋαλώδη) χρήση. Κάθε θεραπευτική δόση περιέχεται σε φιαλίδια που προορίζονται για εφάπαξ χρήση. Το Lucentis συμμορφώνεται με τις συγκεκριμένες απαιτήσεις της Φαρμακοποιίας για τα οφθαλμικά διαλύματα, οι οποίες είναι αυστηρότερες από εκείνες για τα παρεντερικά (δηλαδή ενδοφλέβια) προϊόντα. Τα δε φιαλίδια του Avastin, που προορίζονται για ενδοφλέβια χορήγηση σε ορισμένες μορφές καρκίνου, πληρούν τα πρότυπα παραγωγής για τις ενδοφλέβιες φαρμακοτεχνικές μορφές φαρμάκων, τα οποία επιτρέπουν υψηλότερη συγκέντρωση σωματιδίων σε σχέση με τις φαρμακοτεχνικές μορφές για οφθαλμική χρήση. Το Avastin δεν πληρεί τα πρότυπα παραγωγής για ενδοφθάλμια (ενδοϋαλώδη) χρήση. Άλλωστε, η ανάλυση βάσης δεδομένων των Gower et al έδειξε υψηλότερο κίνδυνο οφθαλμικής φλεγμονής με το μη αδειοδοτημένο ενδοϋαλώδες Avastin σε σύγκριση με το Lucentis. Ωστόσο, αξίζει να σημειωθεί, ότι και η ίδια η Roche(παρασκευάστρια του avastin εταιρεία) από το 2009 έχει στείλει επίσημη ανακοίνωση προς όλους τους επαγγελματίες υγείας, με την οποία τονίζει ότι η εταιρεία δεν έχει θέσει υπό μελέτη για οφθαλμολογική χρήση τη δραστική ουσία μπεβασιζουμάμπη και η οποία δεν έχει εγκριθεί σε παγκόσμιο επίπεδο από καμία Υγειονομική Αρχή για τέτοια χρήση. Το πρόβλημα δυστυχώς παραμένει, αφού όπως όλα δείχνουν, κάποιοι γιατροί αρνούνται να συμμορφωθούν με τις οδηγίες και τις συστάσεις της πατασκευάστριας του Avastin εταιρείας, η οποία τονίζουμε ότι δεν ευθύνεται καθόλου γι’ αυτό και είναι καλυμμένη νομικά εφόσον έχει στείλει επίσημη οδηγία, χωρίς όμως να σκέφτονται ότι μπορεί να εκθέσουν σε κίνδυνο τους ίδιους τους ασθενείς τους.
